El siguiente texto es una síntesis y traducción del artículo publicado originalmente en el Journal of Neurorestoratology sobre nuestras investigaciones de recuperación de músculos atrodiados mediante la terapia celular. Cita: Moviglia, G.A. et al. (2018) Local immunomodulation and muscle progenitor cells induce recovery in atrophied muscles in spinal cord injury patients.
Objetivos: Restaurar el trofismo muscular y la capacidad contráctil voluntaria mediante terapia celular en músculos atrofiados en pacientes con lesión de médula espinal.
El escenario: Tratamiento ambulatorio, Buenos Aires, Argentina.
Métodos: Después de recibir terapia celular de la médula espinal y una rehabilitación intensiva, 7 pacientes con lesión crónica completa de la médula espinal (SCI) (4 personas con paraplejia y 3 personas con cuadriplejia) recuperaron la actividad eléctrica muscular en territorios previamente denervados. Sin embargo, persistieron los signos de atrofia muscular grave. Buscando revertir la atrofia muscular crónica, se implantaron músculos atrofiados con actividad eléctrica con macrófagos autólogos de tipo 1 (Mo1) y células T helper 1 específicas de tejido autólogo (Th1) asociadas a células progenitoras musculares autólogas (MPC). Las células Mo1 y Th1 utilizadas fueron llamadas Células Efectoras (CE). Cada músculo recibió entre 6 y 8 implantes, uno cada 6 semanas. La terapia celular se combinó con un programa intensivo de rehabilitación.
Los resultados: El sonograma y los signos histológicos de recuperación comenzaron ocho semanas después del primer implante. Los sonogramas mostraron un aumento progresivo del volumen muscular y el reemplazo gradual del tejido muscular hiperecogénico por bandas musculares hipoecogénicas (que se asemejan a la estructura muscular normal). Las nuevas bandas se distribuyeron paralelamente al eje principal del músculo, a lo largo de toda la longitud muscular. Las muestras histológicas de las bandas hipoecógenas mostraron tejido muscular nuevo y normal. Se observaron cambios en 7/7 pacientes. Se detectaron eventos secundarios no significativos en algún paciente durante los 24 meses de seguimiento.
Conclusiones: Los resultados que se presentan aquí sugieren que la combinación de la inmunoterapia y la terapia celular regenerativa puede desempeñar un importante papel terapéutico en la recuperación clínica e histológica de la atrofia muscular crónica.
Introducción
En los últimos 15 años, nuestro grupo ha trabajado en protocolos de terapia celular para regenerar las conexiones entre ambos segmentos de la médula espinal en pacientes con lesión de médula espinal crónica completa. Uno de los principales problemas que este programa celular abordó fue la existencia de un tejido cicatrizante en el lugar de la lesión de la médula espinal. Similar a lo que sucede con el músculo fibrótico, los tipos de colágeno 1 y 3 presentes en el lugar de la cicatriz, son los principales obstáculos para que las vías de la médula espinal reconecten ambos extremos. Los axones y las dendritas, así como las nuevas neuronas de interconexión, no pueden crecer en este tipo de matriz extracelular fibrótica. Para superar este problema, nos basamos en el hecho establecido por varios autores que han postulado que el entorno de Mo1 y Th1 promueve la diferenciación hacia atrás de los miofibroblastos en fibroblastos normales, así como favorece la glía y el desarrollo neuronal. Siguiendo estos conceptos, así como los hallazgos previos se postuló que el uso de células efectoras autólogas (CE) contra los antígenos del tejido nervioso central, asociadas con las células progenitoras neurales autólogas (CNF), podría promover la regeneración de la fibra neural, la glía y la interconexión de las neuronas y revertir la calidad del tejido cicatricial. Por lo tanto, el tratamiento podría inducir la reconexión entre ambos segmentos de la médula espinal lesionada.
Para probar la viabilidad de este enfoque celular combinado para pacientes con lesión de médula espinal crónica completa, se realizó un ensayo de fase I y II entre 2013 y 2015. Como resultado de este tratamiento, los músculos previamente denervados mostraron signos de actividad eléctrica asociada con la intención voluntaria de movimiento muscular de los pacientes.
Aunque el registro electromiográfico sugería la reinervación y los pacientes continuaron la rehabilitación, se observaron muy pocos signos de recuperación del trofismo muscular. El examen histológico de los músculos comprometidos mostró severos signos de atrofia muscular con infiltración de fibras y grasas (Fig. 1). La inmunohistoquímica reveló la presencia de algunas placas neuromusculares en las fibras musculares atróficas, coincidiendo con los signos electromiográficos. Las células progenitoras musculares del intersticio, en lugar de las células satélites, no parecían integrarse con las fibras musculares preexistentes y la matriz de endomisio era rica en fibras de colágeno de tipo I.

Debido a que la terapia combinada de células efectoras autólogas con células progenitoras neurales autólogas parecía superar el obstáculo de la cicatrización crónica de la médula espinal permitiendo la reconexión entre los dos extremos de la médula espinal, y debido a que no era suficiente la restauración de la actividad eléctrica muscular para mejorar las condiciones del trofismo muscular, nuestro grupo decidió implantar localmente en los músculos afectados células efectoras autólogas y células progenitoras de músculo autólogas.
Postulamos la hipótesis de que las células implantadas podrían revertir la fibrosis de endomisio a una matriz extracelular pro regenerativa, que permitiría la recuperación de las fibras musculares atrofiadas reinervadas, haciéndolas funcionales.
En el presente documento se describen los signos de eficacia basados en los cambios clínicos, sonográficos e histológicos observados en 7 pacientes crónicos con SCI completa.
2.4 Los pacientes
Siete pacientes crónicos con lesión de médula espinal completa fueron seleccionados de un grupo de pacientes previamente tratados con terapia de células de la médula espinal y rehabilitación intensiva en lista durante 12 meses. Todos los pacientes eran ASIA A en las Normas Internacionales para la Clasificación Neurológica de Lesiones de la Médula Espinal.
Los signos sonográficos de la atrofia muscular se definieron como: cambios en la ecogénesis (estructura muscular hipoecogénica normal reemplazada por una imagen hiperecogénica secundaria a la infiltración de tejido fibroso y graso), cambios en el volumen (menor grosor y extensión de lo que se esperaba para cada músculo) (Fig. 2).
Las características clínicas de los músculos implantados fueron: ausencia de movimiento voluntario (0 en la escala de Kendal), ausencia de tono muscular y disminución de volumen. Todos los músculos implantados dan positivo en la actividad eléctrica medida con la aguja EMG cuando hay un deseo voluntario de contracción (Fig. 2).

La aprobación ética para reportar este caso se obtuvo del Comité de Investigación Ética de la Universidad Maimónides (08-10-2015 DI 300-DGDOIN/15).
Se obtuvo el consentimiento informado por escrito de los pacientes para que su información anónima fuera publicada en este artículo.
Descripción del procedimiento terapéutico
Músculos con signos clínicos y de sonograma de atrofia severa, pero con actividad eléctrica positiva, fueron seleccionados para ser implantados. El implante se hizo por inyección intramuscular bajo la guía de un sonograma.
Los implantes intramusculares se repitieron cada 6 semanas y se complementaron con una rehabilitación intensiva. Cada músculo recibió de 6 a 8 implantes. Se realizaron biopsias musculares antes del primer implante, después de 4 meses y 12 meses.
3 Resultados
3.1 Seguridad del paciente y evolución clínica
Todos los pacientes implantados toleraron los procedimientos sin ningún evento adverso significativo. Los controles posteriores al implante no mostraron ningún aumento en la concentración de las enzimas musculares: creatinina fosfocinasa y aldolasa. Tampoco hubo variaciones de otros parámetros de seguridad.
La recuperación de la contracción muscular visible y palpable fueron los primeros signos clínicos observados. A ellos siguieron cambios en la postura (mejora de los músculos antigravedad) y su capacidad para realizar movimientos aislados que antes estaban ausentes. Es importante señalar que antes del tratamiento todos los músculos implantados, independientemente de la actividad eléctrica después del deseo voluntario de contracción, no tenían signos de contracción voluntaria: 0 en la escala de KENDAL.
Evolución del sonograma: se observaron cambios en la ecogénesis y en las dimensiones musculares. Estos cambios comenzaron 4 semanas después del primer implante. Todos los músculos implantados mostraron cambios clínicos y de sonografía. La imagen inicial hiperecogénica homogénea, compatible con la atrofia de la fibroadiposa, fue progresivamente reemplazada por bandas hipoecogénicas vistas como áreas negras (Fig. 2). Inicialmente, estas áreas se ubicaron focalmente en el punto implantado, sin embargo, después del segundo implante las bandas negras se distribuyeron en todo el espesor y toda la longitud del músculo.
3.2 Resultados de la biopsia muscular del paciente
Los músculos biopsiados antes y 4 meses después del implante muscular fueron comparados por histología e inmunohistoquímica. En un análisis comparativo, se estudiaron las biopsias previas y posteriores al tratamiento, centrándose, para el control de 4 meses, en la región que parecía estar regenerando el músculo (Figs. 2D banda media y 2F).
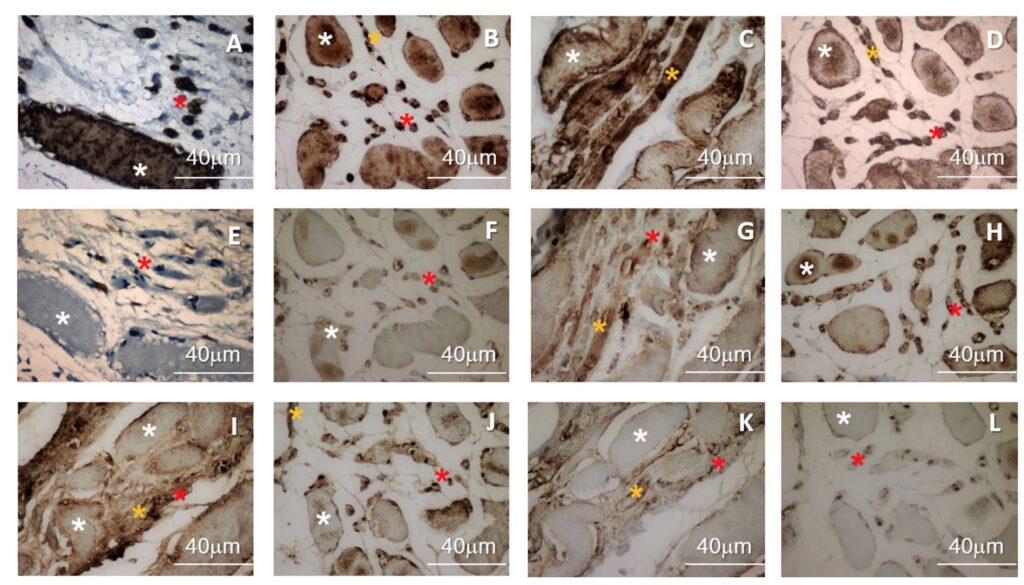
Las biopsias musculares previas al tratamiento revelan una importante infiltración de tejido fibro-adiposo, rodeando unas pocas fibras musculares atróficas (Fig. 2B). Con una alta mag-nificación se pudo observar en el intersticio del músculo un número reducido de células satélites del músculo y la presencia de pocas células pro-regenerativas (Figs. 3A, 3C, 3E, 3G, 3I, y 3K, signos de asterisco naranja) y fibras recién formadas (Figs. 3C, 3G, 3I, y 3K, signos de asterisco amarillo). Estas nuevas fibras musculares formadas se interpretan generalmente como intentos fallidos de regeneración muscular. Estas células y nuevas fibras, como así como las viejas fibras atróficas, son actinas positivas que corroboran la naturaleza relacionada con el músculo (Fig. 3A). Sin embargo, sólo las fibras musculares recién formadas y las células migratorias del intersticio son positivas para la desmina (Fig. 3C), la MyoD (Fig. 3E) y la miogenina (Fig. 3G), que son marcadores de células musculares nuevas o en crecimiento. La tinción de sinaptofisina HRP muestra la presencia de pocas placas terminales neuromusculares en las fibras musculares atrofiadas. (Fig. 2C)
Los portaobjetos de los pacientes tratados durante 4 meses, en el segmento exterior de la biopsia muscular con aguja fina, muestran tejido muscular joven y normal (Fig. 2E). El área intermedia de la misma biopsia de aguja fina (Fig. 2F), muestra un área de regeneración muscular activa. Las marcas de sinapofisina muestran un aumento en el número y el tamaño de las placas terminales neuromusculares (Fig. 2G). La tinción de inmunopero-xidasa para actina (específica para el músculo esquelético) fue positiva en ambas biopsias en estructuras de fibra muscular y células con presunta actividad pro-regenerativa (Fig. 3A y 3B). Este resultado confirma la naturaleza muscular de las fibras en ambas biopsias. La reacción de la desmina muestra que las fibras musculares grandes, las fibras musculares menores recién formadas y las células intersticiales son positivas para ella (Fig. 3D, signos de asterisco naranja, amarillo y blanco, respectivamente). Lo mismo ocurre con el Myo D y la miogenina (Figs. 3F y 3H, signos de asterisco naranja, amarillo y blanco, respectivamente). Estas imágenes refuerzan la suposición de que se trata de un área de regeneración muscular activa.
Para explorar la relación entre esta terapia y la modificación de la matriz extracelular atrófica (músculo endomisio) se encontró que antes del tratamiento las fibras de colágeno tipo I estaban en estrecho contacto con las grandes fibras musculares atróficas y el principal componente del endomisio (Fig. 3I). Al contrario, las fibras de colágeno tipo IV sólo rodeaban las fibras musculares nuevas y frustras (Fig. 3K). El estudio histoquímico de la biopsia por aspiración con aguja fina de los músculos tratados muestra que las fibras de colágeno tipo I estaban casi ausentes del músculo endomisio y las fibras de colágeno tipo IV estaban en estrecha relación con las fibras musculares en crecimiento (Figs. 3J y 3L).
Artículo original
El artículo original en inglés puede leerse en Local immunomodulation and muscle progenitor cells induce recovery in atrophied muscles in spinal cord injury patients.